摘要:葡萄酒相关酵母中主导酒精发酵的酵母菌为Saccharomyces(酵母属)中的Saccharomyces cerevisiae(酿酒酵母),近年来随着葡萄酒品质的多样化与特色化,研究者关注non-Saccharomyces(非酵母属酵母)及非二倍体S. cerevisiae在葡萄酒风味复杂性形成中的作用本研究对酵母菌不同倍性特征及交配型转换等基础理论研究成果进行了综述,重点分析了酵母菌倍性对发酵性能、耐受性及葡萄酒风味形成的影响,为基于倍性研究筛选葡萄酒酿造性能*的菌株提供理论研究基础。研究发现,目前主要的倍性研究针对酿酒酵母开展,但相关研究中缺乏对倍性差异影响表型如耐受性等的分子机制研究,此外,如何在发酵中有效利用非二倍体S. cerevisiae和非酵母属酵母仍依赖于未来针对这些菌株开展的基础倍性研究。
关键词:单倍体;二倍体;多倍体;酿酒酵母;非酵母属
Research Progress in Wine-making Characteristic of Wine-related Yeast Based on Ploidy
LIANG Shu-ying, WANG Chun-xiao*
(Province Key Laboratory of Fermentation Engineering and Biopharmacy, School of Liquor and Food Engineering, Guizhou University, Guiyang Guizhou 550025, China)
Abstract: Saccharomyces cerevisiae, an important specie from the Saccharomyces genus, is the dominant yeast species for conducting alcoholic fermentation in wine-related yeasts. With the diversification and specialization of wine in recent years, researchers have focused on the role of non-Saccharomyces and non-diploid S. cerevisiae in the complexity formation of wine flavour. This study reviews the basic theoretical research results on different ploidy characteristics and mating type conversion of Saccharomyces cerevisiae, focusing on the effects of Saccharomyces cerevisiae ploidy on fermentation performance, tolerance and wine aroma formation, and providesa theoretical basis for screening strains with excellent winemaking performance based on ploidyresearch. However, the molecular mechanism in S. cerevisiae regulating the phenotypic difference such as tolerance capacity by the ploidy difference are still unclear and need deep research. It is still a question on how to effectively use the non-diploid S. cerevisiae and non-Saccharomycesin fermentation, which still rely on the basic ploidy studies of these yeast strains in the future.
Key words: haploid; diploid; polyploid; Saccharomyces cerevisiae; non-Saccharomyces
葡萄酒是在酵母菌等微生物的作用下由葡萄或葡萄汁发酵而成的酒精饮料,研究表明,葡萄表皮、葡萄汁及发酵过程中的葡萄醪包含丰富的野生酵母资源,其中non-Saccharomyces(非酵母属)酵母主导发酵初期,而Saccharomyces(酵母属)如Saccharomyces cerevisiae(酿酒酵母)主导发酵中后期[1]。酵母常以单倍体和二倍体两种营养体存在,由于二倍体比单倍体具有生长优势,因此葡萄酒酿造中分离的酵母常以二倍体形式存在[2-3]。单倍体酵母常出现在实验研究中,一方面可用于杂交或原生质体融合育种,为培育发酵特性良好的酵母菌株提供菌种基础,另一方面对单倍体的某些基因进行敲除、插入或过表达可研究葡萄酒中主要风味物质在酵母菌细胞中的代谢途径,为二倍体酵母菌通过发酵控制影响葡萄酒风味提供理论支持。本研究对酵母菌不同倍性特征及交配型转换等基础理论研究成果进行了综述,并重点分析了酵母菌倍性研究对发酵性能、耐受性及葡萄酒风味形成的关联,为基于单倍体研究选育具有优良葡萄酒酿造性能的二倍体菌株提供理论研究基础。
目前对酵母菌倍性的认识大都以S. cerevisiae为模式菌种进行研究,S. cerevisiae细胞的单倍体有MATa和MATα两种交配型,分别携带a和α两种相反的接合信息[2]。MATα和MATa杂交(即携带相反结合信息的单倍体之间的结合,也叫作异宗配合,图1A)可产生二倍体MATa/α,在自然界中分离到的S. cerevisiae二倍体大多为MATa/α基因型。此外,S. cerevisiae的二倍体还包含MATa/a和MATα/α两种基因型[4],这两种基因型在天然条件下的形成概率极低[5],在实验条件下可通过同宗配合制备这两种基因型[4]。
值得注意的是,二倍体MATa/α和MATa/a、MATα/α在生长上没有显著差异,都可以通过出芽进行繁殖,但它们在细胞形态、产孢和融合能力方面有明显不同[6]。二倍体MATa/a和MATα/α细胞起初为“三叶草”或“脚”形[7],芽殖后产生子代为椭圆形,且不能通过减数分裂产生子囊孢子,或者偶尔会发生,其几率小于1%[8],而二倍体MATa/α细胞起初为哑铃形,芽殖后产生椭圆形子代,且具备产孢能力。此外,二倍体MATa/a和MATα/α细胞可以通过和相反交配型酵母融合,从而生成更高倍型的酵母细胞[6](图1B)。HARARI等[9]在研究中发现,单倍体S. cerevisiae在无胁迫条件下会自发形成二倍体,但在酒精和高盐等胁迫条件下二倍体化的频率大大增加,且二倍体比单倍体更具有环境适应优势,MATa/α菌株的生长状况*,菌株MATa/a或MATα/α次之,生长*差的是单倍体菌株。在相同的环境下,二倍体比单倍体具有更强的生长优势,更能适应恶劣的环境并容忍突变[2]。但二倍体的生长优势也依赖于突变的类型,当有害突变为隐性突变时,二倍体菌株不表达而单倍体菌株表达该有害突变,当有益突变为隐性突变时,二倍体菌株不表达而单倍体菌株表达该有益突变,可以利用单倍体菌株的生长优势将有益突变的单倍体筛选出来,通过进一步杂交获得有益突变的二倍体菌株[4,10]。因此,单倍体在有害隐性突变时受影响,而在有益隐性突变时表现优势[2]。KLEIMAN等[11]对芽殖酵母的基因缺失分析结果显示,单倍体发生有害突变的频率远远超过二倍体,且大部分的有害突变是隐性的。KUTYNA等[4]发现亲本单倍体菌株的甘油产量均高于他们的纯合和杂合二倍体菌株的甘油产量,因此推断决定S. cerevisiae甘油产量的突变是隐性突变。
酵母中除了单倍体和二倍体外,还存在着多倍体和非整倍体。多倍体即细胞中含有两套以上的染色体遗传物质。非整倍体是指核型与正常染色体组(整倍体)不同,即比整倍体增加或丢失几条染色体,其中,结构非整倍体是因染色体部分重排而导致染色体结构发生变化[12]。虽然自然界中的酵母都以单倍体或二倍体的形式存在,但也存在着多倍体和非整倍体。ZHU等[13]从临床中分离的S. cerevisiae有34%鉴定为三倍体或四倍体,36%为非整倍体; EZOV等[14]从以色列卡梅尔山环境中发现了天然存在的三倍体和四倍体S. cerevisiae。
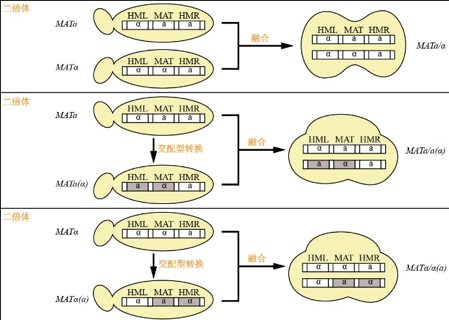
A.二倍体S. cerevisiae的形成
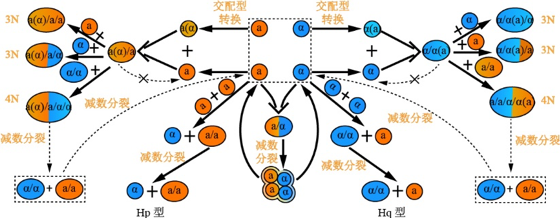
B.不同二倍体和多倍体S. cerevisiae的生命周期
图1酵母交配型的转换及不同二倍体和多倍体的产生示意图[6,12,15]
Fig.1 Schematic diagram of yeast mating type conversion and production of different diploids and polyploids
近年来,在食品领域关于不同酵母倍性的研究越来越多,其中葡萄酒相关酵母的倍性研究中以Saccharomyces的研究*广泛,涉及单倍体、二倍体、多倍体和非整倍体的研究,Brettanomyces的研究次之,包含单倍体、二倍体和多倍体的基础研究,其余酵母菌仅在单一倍性或某两种倍性中有研究,如Torula单倍体的研究、Hanseniaspora二倍体的研究、Pichia多倍体的研究及Dekkera多倍体和非整倍体的研究。Saccharomyces的研究以模式菌种S. cerevisiae的倍性研究*多,相关研究包含交配型转换及鉴定[16-17]、倍性的形成控制[18]、酵母二倍体化的机制[9]、倍性与染色体丢失之间的关系研究[19-20]、非整倍体的形成机制[21-22]、非整倍体的基因组稳定性分析[20]、异宗配合[23]等。non-Saccharomyces的倍性研究以倍性鉴定和细胞生物学基础研究为主,如D. bruxellensis二倍体转化为非整倍体[21]等。与发酵特性相关的单倍体制备仅见于non-Saccharomyces中的Torula[24],其他菌种未见报道。
倍性对S. cerevisiae发酵性能的影响研究主要包含生孢条件、单倍体制备条件[25]、单倍体的诱变与选育[9]、利用优良单倍体进行杂交育种[26]、多倍体的生长生理特性和发酵特性研究、多倍体与非整倍体倍性的鉴定[27]等,涉及的发酵性能包含乙醇产量、发酵速度、残糖、甘油等。有相关研究表明,随着酵母倍性的增加,其生长速度减慢,细胞体积增大,细胞分裂次数增加,芽痕增加[12]。使用亲本二倍体和单倍体分别发酵葡萄汁时,发现发酵速度相同,而且随着发酵的进行,单倍体间会融合形成二倍体。此外,来自不同四分体的单倍体融合率低于来自同一四分体的单倍体融合率,原因是MAT位点与染色体III着丝粒相连而导致杂合性缺失[28]。同一亲本的不同单倍体具有不同的CO2失重、产酒精、残糖、H2S、*醇、酯类等发酵性能,推测是由于多基因控制[17,25,29]。近年来研究者较多关注酵母倍性如何影响葡萄酒发酵及如何利用酵母倍性来提高葡萄酒的风味,但较少研究该影响背后的分子机制。
此外,非整倍体(3n-1、3n-2、4n-1、4n-2、4n-3)增加了基因组的不稳定性,使多个染色体丢失事件时常发生[20],非整倍体也是导致产孢量少的原因之一,但在工业酵母中,由于含有较高数量的基因拷贝数可以适应不断变化的发酵环境,因此可以作为非整倍体的优势特性[22,30]。
葡萄酒酒精发酵过程涉及不同酵母菌种此消彼长的动态变化,该变化与发酵环境息息相关,如许多环境胁迫因子会通过影响酵母的生存代谢改变*终葡萄酒的品质。葡萄酒酒精发酵过程中的环境胁迫因子包含SO2、乙醇、嗜杀毒素、温度、盐及金属离子等,葡萄酒相关酵母对环境胁迫的耐受能力会影响其生存代谢,因此酵母菌的耐受性研究是葡萄酒风味质量研究的基础内容之一,具体见表1和图3。
表1 与葡萄酒相关的酵母菌倍性在耐受性中的应用
Tab.1 Application of wine-related yeast in tolerance analysis based on ploidy
耐受性 | 种名 | 倍性 | 倍性与耐受性的关联 | 参考文献 |
耐SO2能力 | S.cerevisiae | 单倍体 | 含有com2调节子的单倍体菌株耐受SO2能力高于其亲本单倍体菌株 | [31] |
缺失ADE的单倍体突变体,其亚硫酸盐的耐受性增强 | [32] | |||
在0~100 mg/L SO2浓度范围内,单倍体菌株耐SO2能力低于大多数二倍体菌株 | [33] | |||
B.bruxellensis | 多倍体 | 三倍体B. bruxellensis比二倍体耐受SO2 | [27] | |
单倍体至三倍体B. bruxellensis菌株中,耐SO2能力随着倍性增加而增加 | [34] | |||
耐乙醇能力 | S.cerevisiae | 多倍体 | 以不同倍性(单、二和四倍体)的S. cerevisiae为研究对象,发现二倍体的乙醇耐受性*强 | [35] |
S.uvarum | 与S. cerevisiae杂交形成的三倍体菌株耐乙醇能力比*二倍体亲本差 | [36] | ||
S.cerevisiae | 非整倍体 | 非整倍体的乙醇耐受性会高于整倍体(移出额外的染色体Ⅲ,返回整倍体状态,其乙醇耐受性大大降低) | [37] | |
与亲本二倍体菌株相比,非整倍体的耐乙醇(8%)性降低 | [38] | |||
嗜杀毒素 | S.cerevisiae | 单倍体 | 二倍体产孢后,一半孢子失去嗜杀活性 | [39] |
耐温度能力 | S.uvarum | 多倍体 | 与S. cerevisiae杂交形成三倍体菌株,其耐低温(8℃)和高温(39℃)能力高于亲本二倍体菌株 | [36] |
S.cerevisiae | 非整倍体 | 与亲本二倍体菌株相比,非整倍体的耐热性增加 | [38] | |
耐盐及金属离子能力 | S.cerevisiae | 非整倍体 | 与亲本二倍体菌株相比,非整倍体的耐KCl(1mol/L)、铜离子(6.25mmol/L)能力均降低 | [38] |
SO2因其抑菌和抗氧化特性在葡萄酒酿造中广泛应用,但其在发酵过程中的使用会影响酵母菌的活性,因此,发酵主导酵母菌需具备一定的SO2耐受性。相关研究显示,酵母菌对SO2的耐受性随倍性增加而增加[27,33-34]。以单倍体菌株为研究对象,分析可能影响SO2耐受性的基因,发现缺失COM2的单倍体无法在含有1.5mmol/L SO2的培养基中生长,而缺失MSN2、MSN4和HAA1的单倍体菌株均可生长,说明COM2与酵母菌SO2耐受能力相关[31]。此外,SO2耐受能力还可能与ADE有关[32]。
乙醇是酒精发酵的主要产物,其含量随发酵的进行逐渐增加,在葡萄酒酒精发酵结束时其酒精度一般可达10~15% vol,但高浓度乙醇具有抑菌效果,因此,发酵主导酵母菌需具备一定的乙醇耐受性。相关研究表明(表1),非整倍体菌株耐乙醇能力大于整倍体,这一现象与非整倍体菌株中染色体Ⅲ有关[37]。而整倍体菌株中二倍体菌株耐乙醇能力强于其他倍性菌株,研究表明9个基因(ACE2、POL3、PUF4、GFA1、UTH1、JID1、RIM15、ATG11和VPS74)与乙醇耐受性有关[35]。此外,倍性会影响细胞的大小,由于SSD1和UTH1可增加细胞壁对酶的耐受性,因而细胞壁的稳定性也会增加酵母的乙醇耐受性[40]。酵母菌的嗜杀毒素分泌能力可能与其在酒精发酵过程中的竞争优势相关,研究发现,嗜杀能力受倍性的影响,决定嗜杀毒素分泌的基因并不存在于所有的单倍体中,一半来自四分体的单倍体会失去嗜杀活性[39]。目前对于耐嗜杀能力尚无倍性相关研究,但该研究与酒精发酵的控制关联紧密。葡萄酒酿造过程中涉及低温(10℃左右)或高温(37℃或65℃)的冷/热浸渍处理,此外,白葡萄酒的发酵温度推荐为18~22℃,这些葡萄酒酿造条件对酵母菌的温度耐受性提出了一定的要求。研究发现,随着倍性增加,菌株的耐低温和高温能力增加,如三倍体菌株的耐低温(8℃)和耐高温(39℃)均高于其亲本二倍体菌株[36],且非整倍体及其孢子的耐热性高于亲本二倍体及其孢子[38]。
综上所述,酵母菌的SO2、乙醇等耐受性与倍性相关,且某些基因可能直接影响酵母菌的耐受性,基于倍性研究开展耐受能力及相关分子机制研究,可为筛选耐受性强的葡萄酒相关酵母提供重要的理论依据。
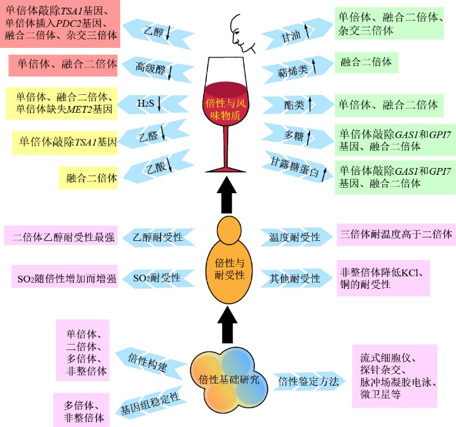
图 3 葡萄酒酵母倍性与耐受性及风味物质形成的关联
Fig.3 The relation of wine yeast ploidy with tolerance and flavor substances formation
酵母菌在葡萄酒酿造过程中,将葡萄汁中的糖转化成乙醇、甘油、*醇、醛类和酯类等物质,还通过自溶释放蛋白质和多糖等细胞成分,这些物质是形成葡萄酒风味的重要物质。S. cerevisiae因具有较强的发酵力和耐受性,是葡萄酒酿造的主导菌种[10]。近年来non-Saccharomyces在葡萄酒风味复杂性研究中受到了关注,Candida、Hanseniaspora、Kloeckera、Metschnikowia、Pichia、Schizosaccharomyces、Torulaspora、Williopsis、Zygosaccharomyces等与S. cerevisiae混合发酵可以降低乙醇和H2S含量,增加酯类、甘油、萜烯类和*醇含量[1,41-43]。研究者仍较多关注S. cerevisiae及其近亲种S.uvarum的倍性对葡萄酒风味复杂性的影响,其他酵母菌种的相关倍性研究较少,未来在S. cerevisiae倍性研究基础上开展non-Saccharomcyes的倍性研究将促进葡萄酒风味的多样化与复杂性。
乙醇是葡萄酒的主要成分之一,近年来部分研究聚焦于低醇或无醇葡萄酒的酿造,研究发现可通过酵母菌的倍性变化降低乙醇产量(表2):(1)通过筛选低产乙醇单倍体,并进一步融合成低产乙醇二倍体[25,44],可实现降低乙醇的目标;值得注意的是,WYK等[16]融合获得的二倍体菌株在乙醇产量方面并无显著差异。(2)通过在单倍体菌株中插入或敲除某些基因来降低乙醇含量。研究表明单倍体菌株中插入pdc2基因会使酒精度降低13%[45],进一步融合为低产乙醇的二倍体后,与二倍体亲本菌株相比,总酒精度降低了7.4%;另一研究发现TSA1基因缺失可降低乙醇含量[46]。(3)通过种间杂交形成多倍体从而降低乙醇含量。 LAIRÓN-PERIS等通过种间杂交(S. uvarum×S. cerevisiae)获取了低产乙醇的异源三倍体H14A7,该三倍体中低表达GPX2、AARE1、NDE2和ADH2基因[47]。
甘油是酒精发酵的主要副产物之一,可赋予葡萄酒圆润的口感,增加复杂性。甘油产量主要受代谢条件和菌株差异影响[43,47],研究发现葡萄酒S. cerevisiae的甘油产率明显低于其他工业S. cerevisiae[48]。S. bacillaris、C. stellata、Starmerella bombicola(球拟假丝酵母)、H. uvarum、M. pulcherrima、Issatchenkia orientalis和L. thermotolerans能增加甘油产量[43,49],而C. sake会降低甘油含量[50]。但相关倍性研究主要集中在Saccharomyces中:由于发生性状分离,同一株二倍体亲本所获取的单倍体后代表现不同的甘油产量[3,17,29],通过筛选高产甘油的单倍体菌株,可进一步杂交形成高产甘油的二倍体[3,44]。S. uvarum和S. cerevisiae杂交获得的异源三倍体H14A7高产甘油[47]。倍性增加造成甘油产量增加可能是因为在融合过程中,引发了GPD1和GPD2的过表达,从而使甘油含量增加。
酵母菌硫代谢的中间产物之一为具有臭鸡蛋气味的H2S,属于葡萄酒的不良风味物质之一[26]。刘美玲等[29]以4株高产H2S的野生二倍体S. cerevisiae(NX11315、LFE1225、LFN524和LFP525)出发制备出6株低产H2S、5株中产H2S和4株高产H2S的单倍体菌株,推测与H2S产量相关的基因为隐性基因;而江璐[3]发现,低产H2S的二倍体S. cerevisiae菌株44y7的单倍体后代出现了高产、低产和不产H2S的菌株,可能是等位基因分离导致性状分离,使高产H2S的基因性状得以表达。在本课题组研究中,WANG等[26]研究发现,杂合二倍体菌株GM1(LFN524高产H2S单倍体和LFP525低产H2S单倍体杂交而成)和纯合二倍体菌株UCD932(所产生单倍体皆不产H2S)都不产H2S,但二株菌的硫代谢相关基因表达情况完全不相同,说明了菌株遗传背景和多基因参与对H2S代谢的影响。
酯类物质与葡萄酒的香气特征密切相关。江璐[3]筛选获得两株高产酯类的S. cerevisiae单倍体(174y1-3和112y4-45),其中乙酸乙酯的产量*,李丽等[17]从野生二倍体S. cerevisiae中筛选获得两株高产乙酯的单倍体菌株(31y3-29和174y-26),其中乙酸苯乙酯的产量*,赋予发酵液玫瑰花香。AGARBATI等[51]研究发现,经单倍体融合后的二倍体菌株与亲本二倍体菌株相比,其乙酸异戊酯产量增加,而乙酸乙酯产量却减少,WYK等[16]的结果与之相似,发现融合后的二倍体菌株增加了乙酸酯的产量。相关研究表明,Schizosaccharomyces、Candida pulcherrima(美极假丝酵母)、Hanseniaspora guilliermondii(季也蒙有孢汉逊酵母)、Pichia anomala(异常毕赤酵母)、P. fermentans、P. membranifaciens、T. debrueckii等都能提高葡萄酒中的酯类含量(乙酸己酯、乙酸乙酯、乙酸异戊酯和2-苯乙酸乙酯等)[41,52-53],但目前尚无这些菌种的倍性研究报道。
*醇与葡萄酒的香气特征直接相关,还可进一步通过酯化反应影响*醇酯的含量,通过氧化反应影响醛类(氧化味)的形成。相关研究一方面通过制备单倍体从中筛选出低产或高产*醇的菌株:江璐[3]筛选获得两株高产*醇的单倍体菌株33y7-43和12y4-4y,其中异戊醇的产量*;李丽等[17]从野生二倍体S. cerevisiae中获得一系列性状分离的单倍体,其中9株单倍体的*醇产量比二倍体亲本菌株低近60%,单倍体菌株的**醇产量为135.2mg/L。另一方面,通过单倍体融合为二倍体改变*醇的含量,AGARBATI等[51]通过单倍体融合为二倍体使异丁醇、戊醇及异戊醇产量降低。虽然Lodderomyces elongisporus(长孢洛德酵母)高产异戊醇和2-苯乙醇[54],Saccharomycodes(类酵母属)、Schizosaccharomyces(裂殖酵母属)、M. pulcherrima、I. orientalis、H. uvarum和H.vineae可影响*醇的产量[52,55],但目前尚无这些菌种的倍性研究报道。
多糖可影响葡萄酒的“黏度”,使酒体具备丰满的风格。GONZALEZ等[10]发现缺失GAS1和GPI7的单倍体S. cerevisiae高产甘露糖蛋白和多糖,其释放量分别是没有基因缺失的对照单倍体S. cerevisiae菌株的7和9倍,进一步以基因缺失的单倍体菌株为亲本进行杂交得到杂合和纯合二倍体菌株,纯合二倍体菌株与其亲本单倍体菌株非常相似,高产甘露糖蛋白和多糖,而杂合二倍体菌株甘露糖蛋白的产量均低于没有基因缺失的对照单倍体菌株。研究表明,Hanseniaspora osmophila、P. fermentans、S. ludwigii、Zygosaccharomyces bailii(拜耳接合酵母)、L. thermotolerans、M. pulcherrima和S. ludwigii可增加葡萄酒中多糖的浓度[56],但尚缺乏相关倍性研究。
Candida、Kloeckera、Pichia、Metschnikowia、Sporidibolus、Aureobasidium、Hanseniaspora和Issatchenkia具有较高的糖苷酶活性,可通过释放糖苷结合的风味化合物提升葡萄酒的香味,如β-葡萄糖苷酶可提高葡萄酒中萜烯醇的浓度[57]。Debaryomyces pseudopolymorphus、Debaryomyces vanriji、P. fermentans、C. stella、C. sake、H. vineae、M. pulcherrima和S. bacillaris与葡萄酒中萜烯醇(香茅醇、香叶醇及橙花醇)的产量有关[52]。虽然较少S. cerevisiae菌株具备前述non-Saccharomyces菌种高产糖苷酶的特性,但研究发现,其单倍体表现出高于二倍体菌株的芳樟醇产量,而具有复杂基因背景的S. cerevisiae T73-4非整倍体菌株(近二倍体)展现了三倍于传统实验室菌株(包含单倍体和二倍体)的芳樟醇产量,说明具有复杂基因背景的菌株可能更适合产生异源单萜[58]。
综上所述,目前大部分研究关注了倍性差异对风味物质的影响,但未展开单倍体相关基因分析,因此尚未形成相关风味物质产量受倍性影响的分子机制,未来的研究可以目前研究较多的乙醇和甘油为例,拓展倍性差异影响风味物质的分子机制,为酿造不同风味的葡萄酒提供理论依据。
表2葡萄酒相关酵母倍性对葡萄酒风味物质的影响
Tab.2 Effect of ploidy of wine-related yeast on flavoring substances in wine
对葡萄酒风味的影响 | 种名 | 倍性研究 | 参考文献 |
降低乙醇 | S. cerevisiae | 敲除单倍体菌株中的TSA1基因 | [46] |
单倍体与二倍体的比较 | [33] | ||
单倍体菌株中插入PDC2基因,再进一步融合为二倍体 | [45] | ||
单倍体融合为二倍体菌株 | [44] | ||
S. uvarum | 种间杂交(S. uvarum×S. cerevisiae)形成三倍体 | [47] | |
增加甘油 | S. cerevisiae | 单倍体筛选 | [3,17,29] |
单倍体融合为二倍体菌株 | [44] | ||
S. uvarum | 种间杂交(S. uvarum×S. cerevisiae)形成三倍体 | [47] | |
降低H2S | S. cerevisiae | 单倍体筛选 | [3,17,29] |
单倍体菌中插入MET2基因 | [59] | ||
单倍体与二倍体比较 | [33] | ||
单倍体融合为二倍体菌株 | [26,51] | ||
增加酯类 | S. cerevisiae | 筛选单倍体 | [3,17,29] |
单倍体融合为二倍体菌株 | [16,51] | ||
降低*醇 | S. cerevisiae | 筛选单倍体 | [3,17,29] |
单倍体融合为二倍体菌株 | [51] | ||
增加*醇 | S. cerevisiae | 筛选单倍体 | [3,17,29] |
增加萜烯类 | S. cerevisiae | 单倍体融合为二倍体菌株 | [58] |
增加甘露糖蛋白和多糖 | S. cerevisiae | 敲除单倍体菌株中的GAS1和GPI7基因缺失的单倍体,再融合形成二倍体 | [10] |
降低乙酸 | S. cerevisiae | 单倍体融合为二倍体菌株 | [16] |
降低乙醛 | S. cerevisiae | 敲除单倍体菌株中的TSA1基因 | [26,46] |
增加乙醛 | S. cerevisiae | 单倍体融合为二倍体菌株 | [51] |
葡萄酒相关酵母与葡萄酒的风味特征形成息息相关,而酵母倍性研究可以促进有益风味和不良风味代谢途径的剖析,为具有稳定有益性状的二倍体菌株筛选和培育提供研究方法。近年来,葡萄酒相关酵母倍性研究取得了一些进展,主要集中在Saccharomyces属中的S.cerevisiae,相对葡萄酒相关酵母而言,研究菌种相当局限。
第一,目前与葡萄酒风味形成相关的酵母倍性研究多以S. cerevisiae为主,其他菌种较少,可能与其他菌种的倍性基础研究较少、生孢和单倍体制备条件明显不同于S. cerevisiae、单倍体存活率低或留存时间短等困难有关。此外,在本课题前期研究中发现,Hanseniaspora属在生孢上非常困难,且不容易判断是否产孢;Schizosaccharomyces虽然生孢非常容易,但由于生长周期的特异性,导致单倍体间很容易融合为二倍体,分离出单倍体在技术上存在一定的困难。在今后的研究中,需结合S. cerevisiae的基础研究成果,开发适用于non-Saccharomyces菌种的基础倍性研究技术,为其进一步的应用提供理论基础。
第二,就S. cerevisiae的倍性研究而言,关于乙醇、H2S和甘油的相关报道较多,而酯类和萜烯类的研究较少,可能与S. cerevisiae的酿造特性有关。亟待在未来的研究中更多关注S. cerevisiae与β-葡萄糖苷酶、酯类和萜烯类等风味形成、Hanseniaspora产β-葡萄糖苷酶进而释放萜烯类物质、S. japonicus在甘油、苹果酸和甘露糖蛋白/多糖代谢、Pichia在酯类和多种芳香化合物(如萜烯、C13-降异戊二烯和C6化合物)代谢等方面的倍性研究,从而为葡萄酒的特色化和多样化生产提供菌种基础。
第三,在S. cerevisiae的倍性中,对于倍性分子机制的研究甚少。近几年的研究集中于倍性差异会导致酵母的耐受性和发酵性能不同,但是没有从分子机制的层面对这一差异作出分析解释。
总之,目前对葡萄酒相关酵母倍性研究的报道较多,但将倍性运用到葡萄酒发酵中的研究甚少,特别是倍性随着发酵进程的变化情况,以及在发酵中如何利用不同倍性酵母等,有待进一步关注。non-Saccharomyces属的基础倍性研究将促进其在葡萄酒发酵中的应用,为增强葡萄酒的风味复杂性提供菌株支持。
参考文献[1] Wang CX, Wu C, Qiu SY. Yeast diversity investigation of Vitis davidii Föex during spontaneous fermentations using culture-dependent and high-throughput sequencing approaches [J]. Food Research International, 2019,126:108582.
[2] 洪玉,杨永军,常登龙,等.酵母菌的倍性及其鉴定方法[J].安徽农业科学,2011,39(17):10109-10111.
[3] 江璐.酿酒酵母单倍体的分离及其发酵特性研究[D].杨凌:西北农林科技大学,2014.
[4] Kutyna DR, Varela C, Stanley GA, et al. Adaptive evolution of Saccharomyces cerevisiae to generate strains with enhanced glycerol production [J]. Applied Microbiology and Biotechnology,2012,93(3):1175-1184.
[5] Paquin C, Adams J. Isolation of sets of a, α, a/α, a/a, and α/α isogenic strains in Saccharomyces cerevisiae [J]. Current Genetics,1982,6:21-24.
[6] 刘慧敏.多倍体酵母合成型V号染色体的重排[D].天津:天津大学,2018.
[7] 杨华军,刘成,马向霞,等.一种酿酒酵母多倍体系列菌株的构建及快速筛选方法[J].食品与发酵工业,2014,40(2):106-110.
[8] 无锡轻工业学院编.微生物学(第二版)[M].北京:中国轻工业出版社,1990:86-96.
[9] Harari Y, Ram Y, Kupiec M. Frequent ploidy changes in growing yeast cultures [J]. Current Genetics, 2018,64(5):1001-1004.
[10] Gonzalez-Ramos D, Gonzalez R. Genetic determinants of the release of mannoproteins of enological interest by Saccharomyces cerevisiae [J]. Journal of agricultural and food chemistry,2006,54(25):9411-9416.
[11] Kleiman M, Tannenbaum E. Diploidy and the selective advantage for sexual reproduction in unicellular organisms [J]. Theory in Biosciences,2009,128:249-285.
[12] 高克慧.酿酒酵母倍性变化对表型和基因表达的影响[D].杭州:浙江大学,2015.[13] Zhu YO, Sherlock G, Petrov DA. Whole genome analysis of 132 clinical Saccharomyces cerevisiae strains reveals extensive ploidy variation [J]. G3: Genes, Genomes, Genetics,2016,6(8):2421-2434.
[14] Ezov TK, Boger-Nadjar E, Frenkel Z, et al. Molecular-genetic biodiversity in a natural population of the yeast Saccharomyces cerevisiae from "Evolution Canyon": microsatellite polymorphism, ploidy and controversial sexual status [J]. Genetics,2006,174(3):1455-1468.
[15] 程光胜,李玲阁,张启光,等.微生物学实验法(第一版)[M].北京:科学出版社,1981:241-246.
[16] Wyk VN, Kroukamp H, Espinosa MI, et al. Blending wine yeast phenotypes with the aid of CRISPR DNA editing technologies [J]. International Journal of Food Microbiology,2020,324:108615.
[17] 李丽,李莹,冯莉,等.酿酒酵母单倍体的分离及其产*醇和乙酯类化合物的特性[J].中国食品学报,2018,18(6):83-92.
[18] Jia B, Wu Y, Li BZ, et al. Precise control of SCRaMbLE in synthetic haploid and diploid yeast [J]. Nature communications,2018,9:1933.
[19] Morard M, Ibáñez C, Adam Ac, et al. Genomic instability in an interspecific hybrid of the genus Saccharomyces: a matter of adaptability [J]. Microbial Genomics,2020,6(10). DOI:10.1099/mgen.0.000448.
[20] Mayer VW, Aguilera A. High levels of chromosome instability in polyploids of Saccharomyces cerevisiae [J]. Mutation research,1990,231(2):177-186.
[21] Ishchuk Op, Zeljko tV, Schifferdecker Aj, et al. Novel centromeric loci of the wine and beer yeast Dekkera bruxellensis CEN1 and CEN2 [J]. PLoS ONE,2016,11(8): e0161741.
[22] Guillamón JM, Barrio E. Genetic polymorphism in wine yeasts: mechanisms and methods for its detection [J]. Frontiers in microbiology,2017,8:806.
[23] Miklos I, Varga T, Nagy A, et al. Genome instability and chromosomal rearrangements in a heterothallic wine yeast [J]. J Basic Microbiol,1997,37(5):345-354.
[24] 窦文芳,高慧,张旦旦,等.圆酵母B84512单倍体的制备及其产赤藓糖醇特性分析[J].食品与生物技术学报,2013,32(12):1327-1332.
[25] 李华,刘丽丽,李娟.酿酒酵母产孢培养基的筛选及单倍体的分离[J].酿酒科技,2008(6):22-24+27.
[26] Wang Cx, Liu M, Li Y, et al. Hydrogen sulfide synthesis in native Saccharomyces cerevisiae strains during alcoholic fermentations [J]. Food Microbiol,2018,70:206-213.[27] Avramova M, Cibrario A, Peltier E, et al. Brettanomyces bruxellensis population survey reveals a diploid-triploid complex structured according to substrate of isolation and geographical distribution [J]. Scientific reports, 2018, 8(1):4136.
[28] Ambrona J, Ramirez M. Analysis of homothallic Saccharomyces cerevisiae strain mating during must fermentation [J]. Applied and Environmental Microbiology, 2007, 73(8): 2486-2490.
[29] 刘美玲,刘延琳.酿酒酵母单倍体的分离及其产硫化氢特性[J].食品科学,2013,34(21):136-139.
[30]Guijo S, Mauricio JC, Salmon JM, et al. Determination of the relative ploidy in different Saccharomyces cerevisiae strains used for fermentation and 'flor' film ageing of dry sherry-type wines [J]. Yeast (Chichester, England), 1997, 13(2):101-117.
[31] Lage P, Sampaio-Marques B, Ludovico P, et al. Transcriptomic and chemogenomic analyses unveil the essential role of Com2-regulon in response and tolerance of Saccharomyces cerevisiae to stress induced by sulfur dioxide [J]. Microbial Cell, 2019, 6(11): 509-523.
[32] Aranda A, Jiménez-Martí E, Orozco H, et al. Sulfur and adenine metabolisms are linked, and both modulate sulfite resistance in wine yeast [J]. Journal of Agricultural and Food Chemistry, 2006, 54(16):5839-5846.
[33]Nadai C, Treu L, Campanaro S, et al. Different mechanisms of resistance modulate sulfite tolerance in wine yeasts [J]. Appl Microbiol Biotechnol, 2016, 100(2):797-813.
[34] Varela C, Bartel C, Roach M, et al. Brettanomyces bruxellensis SSU1 haplotypes confer different levels of sulfite tolerance when expressed in a Saccharomyces cerevisiae SSU1 null mutant [J]. Appl Environ Microbiol, 2019, 85: e02429-18.
[35] Voordeckers K, Kominek J, Das A, et al. Adaptation to high ethanol reveals complex evolutionary pathways [J]. PLoS Genet, 2015, 11(11): e1005635.
[36] Origone Ac, Floresm MG, Rodriguez Me, et al. Inheritance of winemaking stress factors tolerance in Saccharomyces uvarum/S. eubayanus × S. cerevisiae artificial hybrids [J]. International Journal of Food Microbiology,2020,320:108500.
[37] Morard M, Macías Lg, Adam Ac, et al. Aneuploidy and ethanol tolerance in Saccharomyces cerevisiae [J]. Frontiers in Genetics,2019,10:82.
[38] Yona Ah, Manor Ys, Herbst Rh, et al. Chromosomal duplication is a transient evolutionary solution to stress [J]. Proc Natl Acad Sci USA,2012,109(51):21010-5.
[39] Rodríguez-Cousiño N, Maqueda M, Ambrona J, et al. A new wine Saccharomyces cerevisiae killer toxin (Klus), encoded by a double-stranded rna virus, with broad antifungal activity is evolutionarily related to a chromosomal host gene [J]. Applied and Environmental Microbiology,2011,77(5):1822-1832.
[40] Avrahami-Moyal L, Engelberg D, Wenger JW, et al. Turbidostat culture of Saccharomyces cerevisiae W303-1A under selective pressure elicited by ethanol selects for mutations in SSD1 and UTH1 [J]. Narnia,2012,12(5):521-533.
[41] Furlani MVM, Maturano YP, Combina M, et al. Selection of non-Saccharomyces yeasts to be used in grape musts with high alcoholic potential: a strategy to obtain wines with reduced ethanol content [J]. FEMS Yeast Research,2017,17(2). DOI: 10.1093/femsyr/fox010.
[42] Hu LL, Liu R, Wang X. The sensory quality improvement of citrus wine through co-fermentations with selected non-Saccharomyces yeast strains and Saccharomyces cerevisiae [J]. Microorganisms,2020,8(3):323.
[43] Binati RL, Lemos Junior WJF, Luzzini G, et al. Contribution of non-Saccharomyces yeasts to wine volatile and sensory diversity: A study on Lachancea thermotolerans, Metschnikowia spp. and Starmerella bacillaris strains isolated in Italy [J]. International Journal of Food Microbiology,2020,318:108470.
[44] Tapia Sm, Cuevas M, Abarca V, et al. GPD1 and ADH3 natural variants underlie glycerol yield differences in wine fermentation [J]. Frontiers Microbiology,2018,9:1460.
[45] Cuello Ra, Flores Montero kj, Mercado LA, et al. Construction of low-ethanol-wine yeasts through partial deletion of the Saccharomyces cerevisiaePDC2 gene [J]. AMB Express, 2017, 7(1):67.
[46] Garrigós V, Picazo C, Matallana E, et al. Wine yeast peroxiredoxin TSA1 plays a role in growth, stress response and trehalose metabolism in biomass propagation [J]. Microorganisms,2020,8(10):1357.
[47] Lairón-Peris M, Pérez-Través L, Muñiz-Calvo S, et al. Differential contribution of the parental genomes to a S. cerevisiae × S. uvarum hybrid, inferred by phenomic, genomic, and transcriptomic analyses, at different industrial stress conditions [J]. Frontiers in bioengineering and biotechnology,2020,8:129.
[48] Uebayashi K, Shimizu H, Matsuda F. Comparative analysis of fermentation and enzyme expression profiles among industrial Saccharomyces cerevisiae strains [J]. Applied Microbiology and Biotechnology,2018,102(16):7071-7081.
[49] Gobbi M, Comitini F, Domizio P, et al. Lachancea thermotolerans and Saccharomyces cerevisiae in simultaneous and sequential co-fermentation: A strategy to enhance acidity and improve the overall quality of wine [J]. Food Microbiology,2013,33(2):271-281.
[50] Ballester-Tomás L, Prieto JA, Gil JV, et al. The antarctic yeast Candida sake: understanding cold metabolism impact on wine [J]. International Journal of Food Microbiology,2017,245:59-65.
[51] Agarbati A, Canonico L, Comitini F, et al. Reduction of sulfur compounds through genetic improvement of native Saccharomyces cerevisiae useful for organic and sulfite-free wine [J]. Foods,2020,9:658.
[52] Zhang BQ, Shen JY, Duan CQ, et al. Use of indigenous Hanseniaspora vineae and Metschnikowia pulcherrima co-fermentation with Saccharomyces cerevisiae to improve the aroma diversity of Vidal Blanc Icewine [J]. Frontiers in Microbiology,2018,9:2303.
[53] Boscaino F, Ionata E, LA Cara F, et al. Impact of Saccharomyces cerevisiae and Metschnikowia fructicola autochthonous mixed starter on Aglianico wine volatile compounds [J]. Journal of food science and technology,2019,56(11):4982-4991.
[54] Ruiz J, Ortega Na, Martín-Santamaría M, et al. Occurrence and enological properties of two new non-conventional yeasts (Nakazawaea ishiwadae and Lodderomyces elongisporus) in wine fermentations [J]. International JournaloffoodMicrobiology,2019,305: 108255.
[55] Liu PT, Lu L, Duan CQ, et al. The contribution of indigenous non-Saccharomyces wine yeast to improved aromatic quality of Cabernet Sauvignon wines by spontaneous fermentation [J]. LWT-Food Science and Technology,2016,71:356-363.
[56] Domizio P, Liu Y, Bisson LF, et al. Use of non-Saccharomyces wine yeasts as novel sources of mannoproteins in wine [J]. Food microbiology,2014,43:5-15.
[57] de Ovalle S, Cavello I, Brena BM, et al. Production and characterization of a β-glucosidase from Issatchenkia terricola and its use for hydrolysis of aromatic precursors in Cabernet Sauvignon wine [J]. LWT-Food Science and Technology,2018,87:515-522.
[58] Rico J, Pardo E, Orejas M. Enhanced production of a plant monoterpene by overexpression of the 3-hydroxy-3-methylglutaryl coenzyme A reductase catalytic domain in Saccharomyces cerevisiae [J]. Applied and environmental microbiology,2010,76(19):6449-6454.
[59] Huang C, Roncoroni M, Gardner Rc. MET2 affects production of hydrogen sulfide during wine fermentation [J]. Applied Genetics and Molecular Biotechnology,2014,98(16):7125-7135.